
陈填烽教授团队在国际著名期刊连发两篇论文 报道肿瘤多模态精准治疗新进展
陈填烽教授团队基于肿瘤的生化特性,设计了肿瘤靶向性的生物响应纳米药物,成功实现了对肿瘤的放疗-化疗-光热治疗同步化的多模态精准治疗。相关研究成果分别发表在材料领域权威期刊ACS NANO(影响因子13.709)及Adv Funct Mater (影响因子13.325),并被Adv Funct Mater选为该期封面论文。至今,该团队已在Angew Chem Int Edit及ACS Nano等本领域重要期刊上发表研究论文超过200篇,近30篇论文被国际著名学术期刊当作封面文章发表。
基于肿瘤的生化特性进行化学设计,已经成为创造和发现创新药物的重要途径。将纳米化学设计与生物医学应用相融合,利用化学分子及材料的生物响应特性,进行靶向修饰,可实现肿瘤的精准打击,为肿瘤的药物运输供新的策略与思路。利用肿瘤细胞和正常细胞膜受体表达的差异性,将靶向分子桥联嫁接在纳米粒子的表面,使其通过抗原/抗体介导的主动靶向作用识别肿瘤细胞,是设计肿瘤靶向纳米药物的主要策略。肿瘤细胞所处的微环境具有弱酸性的特点,因此,可利用酸不稳定的β-羧酸基团可逆地修饰氨基,从而形成了具有表面电荷翻转能力的纳米体系。最近,陈填烽教授团队与中国科学院深圳先进技术研究院喻学锋教授团队合作,开发了一种具有表面电荷翻转能力和生物响应控制释放的黑磷量子点(BPQDs)纳米体系用于黑色素瘤的放射治疗。该纳米药物以多种生物响应性聚合物分子作为修饰剂,合成具有酸响应和生物相应能力的聚合物纳米粒子,并负载BPQDs作为肿瘤放疗增敏剂,发现该纳米复合体系表现出优越的肿瘤靶向能力、良好的生物安全性、高效的放射增敏作用和显著的体内抗肿瘤效果(ACS NANO2018, 12, 12401)。该论文的第一作者为2016级博士陈樑。
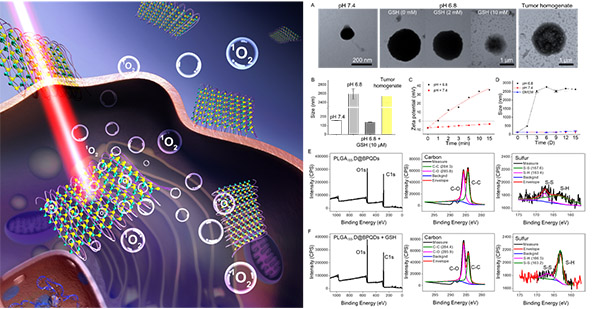
1、具有酸响应能力和生物响应性能力的纳米体系PLGA-SS-D@BPQDs的设计及其作用原理。
此外,该团队还基于碳纳米管的光热转换特性,以有机硒作为抗肿瘤药物分子,设计了光热驱动的光热-化疗一体化纳米药物。该团队利用具有光热转换效应的碳纳米管作为载体,装载了具有药物化疗作用的有机硒小分子,在修饰上特异性靶向多肽的基础上,还装备了具有酸响应性的三嵌段聚合物,最终得到了一种具有表面电荷翻转能力的光热控制纳米管体系。在近红外激光的激发下,纳米管在发挥热疗作用的同时,将自身所装载的化疗药物释放,进一步加强了对肿瘤细胞的杀伤作用,从而增强化疗-光热治疗的效果,为肿瘤个性化精准治疗提供新的选项(Adv Funct Mater,2018, 28: 1805225)。硕士生梅超明及汪妮是该文章的共同第一作者。
图2、光驱动的光热-化疗一体化纳米药物。(A) 具有表面电荷翻转能力的光热控制纳米管体系Se@CNTs的设计及其作用原理示意图。(B)纳米药物治疗后荷瘤小鼠肿瘤区域的T2加权核磁共振图像。
上述工作的开展,为开发基于肿瘤的多模态精准治疗打下了重要的基础。上述研究工作得到了中组部万人计划青年拔尖人才项目、国家高技术研究发展计划(863计划)项目及国家自然科学基金等项目的资助。
论文信息:
1.Leung Chan, Pan Gao, Wenhua Zhou, Chaoming Mei, Yanyu Huang, Xue-Feng Yu,*, Paul K. Chu, Tianfeng Chen*. ACS NANO. 2018, 12, 12401-12415.
论文链接:https://pubs.acs.org/doi/abs/10.1021/acsnano.8b06483
2.Chaoming Mei, Ni Wang, Xueqiong Zhu, Ka‐Hing Wong, Tianfeng Chen*. Advanced Functional Materials. 2018, 28, 1870325.
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.201870325
责编:李伟苗




